
推荐语:本文2016发表在Journal of Cell Science上,是一篇典型的外泌体miRNA文章,包括来源细胞的外泌体分离、鉴定、miRNA芯片检测及miRNA功能研究等多个方面,可为该研究方向的客户提供参考!在这项研究中,分离出人类脂肪源性MSC(供体细胞)分泌的外泌体(adMSC-Exo),并研究了它们在血管生成中的作用,结果发现adMSC-Exo可被内皮细胞(受体细胞)吸收,并显着促进体外和体内的血管生成。进一步研究表明,miR-125a在adMSC-Exo中富集,并通过靶向DLL43'非翻译区抑制其表达来抑制血管生成。此外,adMSC-Exo及其外体转移的miR-125a可通过抑制DLL4表达促进内皮尖细胞的形成,从而调节内皮细胞血管生成。总之, adMSC-Exo可通过将miR-125a转移至内皮细胞抑制DLL4来促进血管生成。
中康博提供:外泌体提取 + 外泌体电镜鉴定 + 外泌体miRNA检测
研究思路图:
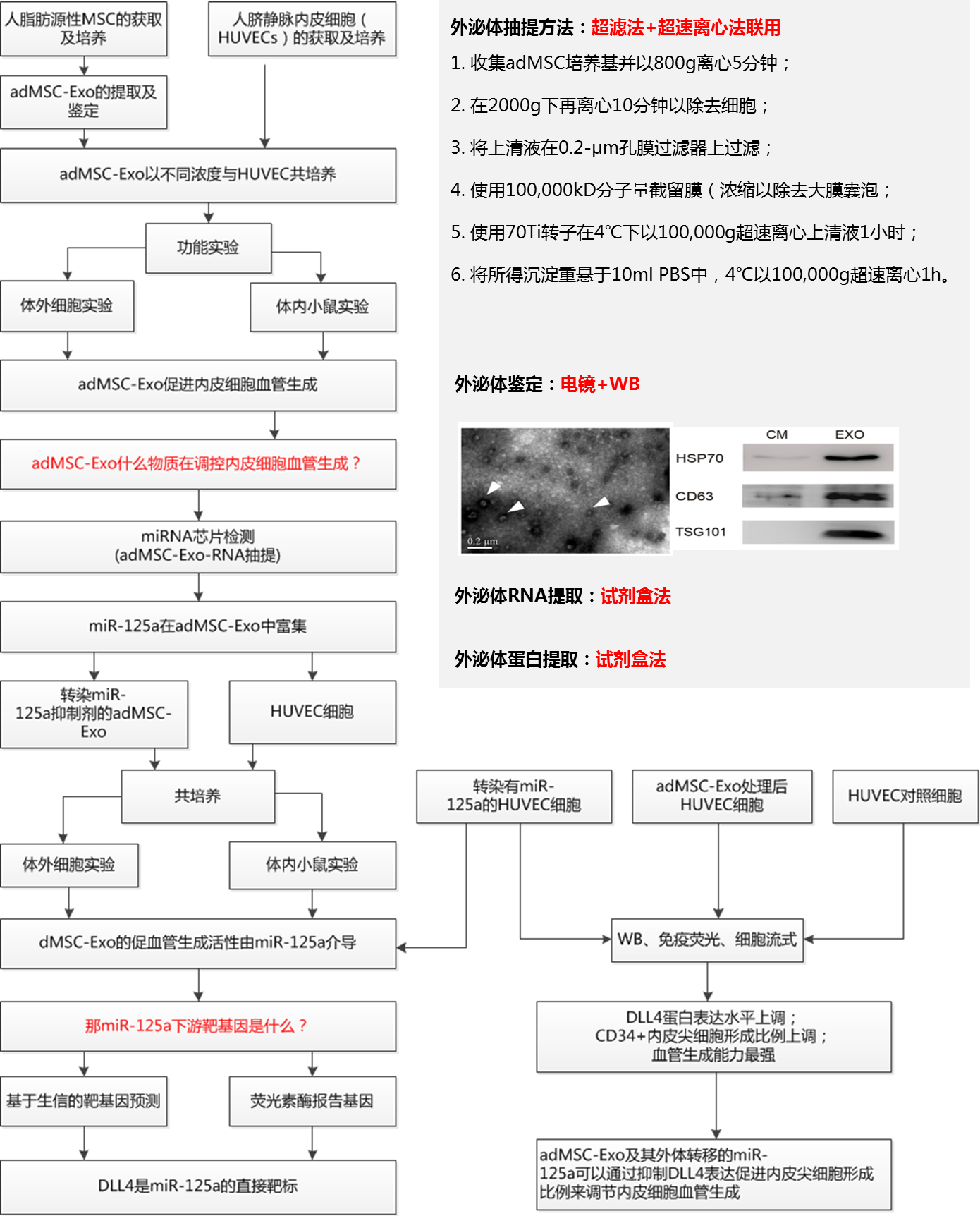
研究结果
1、 adMSC-Exo的分析和表征(即提取及鉴定)
为了研究adMSC-Exo在内皮细胞血管生成中的作用,首先从adMSCs培养上清液中分离外泌体并加以鉴定。透射电子显微镜结果显示出直径为30-100nm的圆形膜结合囊泡(图1A)。WB实验在外泌体中验证出标记蛋白CD63,TSG101和HSP70家族蛋白(图1B)。为了进一步研究adMSC-Exo是否可以转移到内皮细胞中,用Dil染料标记外泌体并在体外与人脐静脉内皮细胞(HUVEC)温育,6h后,发现超过90%的HUVEC是Dil阳性的,这表明Dil标记的外泌体成功转移到内皮细胞质中(图1C)。图S2所示的结果进一步证实图1C中的红色标记是由真正的外泌体内化引起的,而不是由游离Dil染料引起的。综合起来,这些数据表明adMSC-Exo可以成功分离,并可以有效地转移到HUVEC。
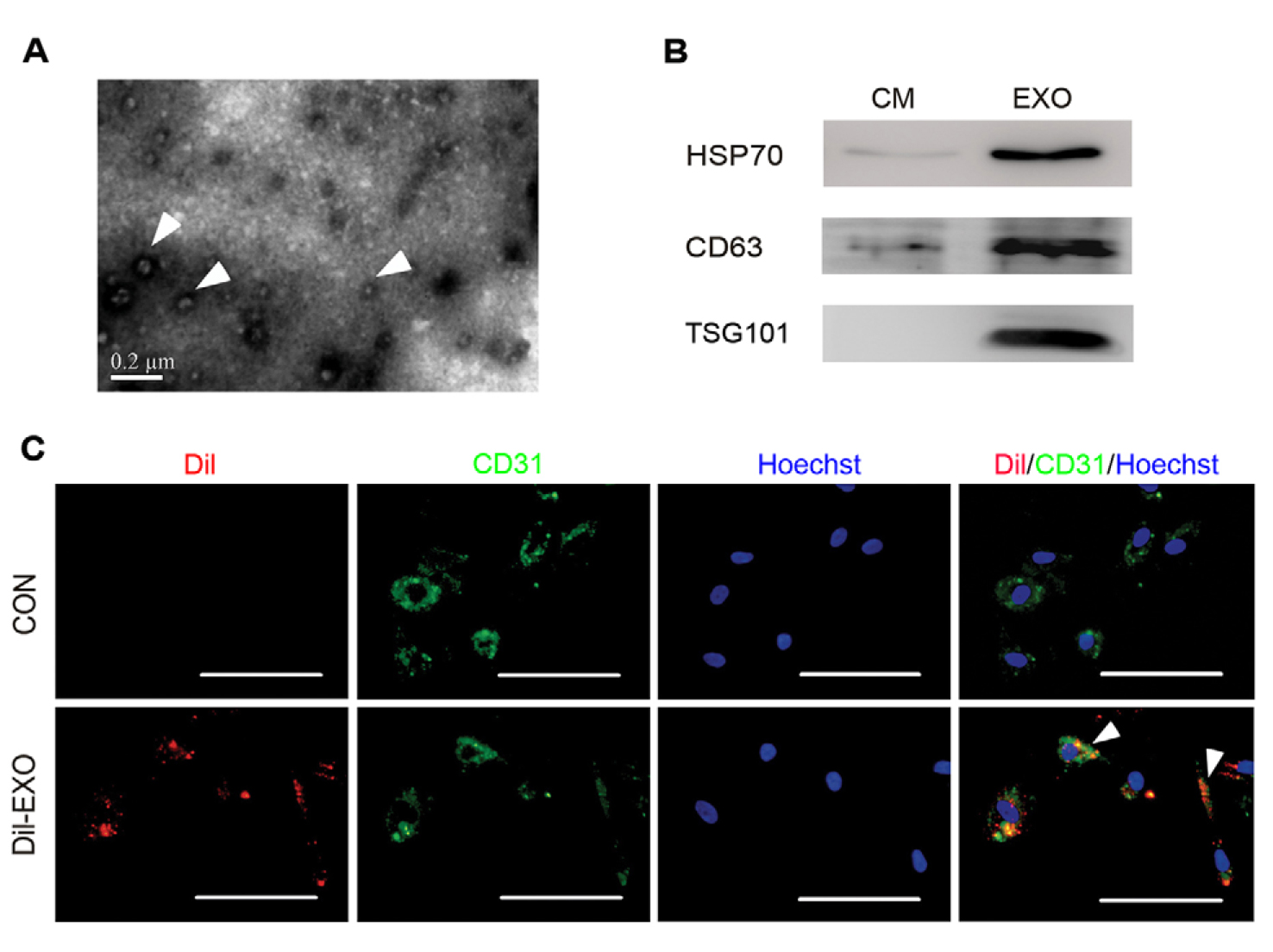
图1. adMSC-Exo的表征。 (A)adMSC-Exo的电镜图 箭头指示外泌体。 比例尺: 200nm。 (B)外泌体分子标志物CD63/TSG101/HSP70的WB印迹图。 EXO为adMSC-Exo,CM为MSC条件培养基。 (C)将HUVECs与Dil标记的外泌体(Dil-EXO; Dil显示为红色)或载体对照孵育,并且在HUVEC中观察外泌体的摄取情况。用抗CD31抗体(绿色)共培养内皮细胞,用Hoechst 33342(蓝色)染色细胞核。 箭头指示为CD31阳性内皮细胞内的Dil标记的外泌体。 比例尺:50 um
2、adMSC-Exo在体外和体内促进内皮细胞血管生成
为了研究adMSC-Exo对血管生成的作用,用不同浓度的外泌体(25μg/ ml,50μg/ ml,100μg/ ml和200μg/ ml)处理原代HUVEC 48h,结果发现当外泌体浓度在0-100μg/ ml之间时,促血管生成基因Ang1和Flk1在HUVEC中的表达水平显著上调(图2A,B),抗血管生成基因Vash1和TSP1的表达水平显著下调(图2C,D)。此外,还发现Flk1和Ang1表达水平在用100μg/ ml adMSC-Exo处理时表达水平最高。因此,以下实验中均用100μg/ ml外泌体处理HUVEC。研究进一步通过试管形成实验评估了adMSC-Exo对体外血管生成的影响。正如预期的那样,通过增加管长(图2E,F)和分枝数(图2E,G)确定,外泌体处理组中HUVECs的管形成显著增强。为了评估adMSC-Exo在体内内皮细胞血管生成中的作用,研究通过皮下注射HUVECs或与adMSC-Exo混合的HUVECs在免疫缺陷小鼠中进行基质胶塞实验测定。与体外数据一致,免疫组织化学分析显示外泌体处理组中的血管结构数目比体内未处理组高(图2H)。总之,以上结果表明adMSC-Exo促进体内和体外内皮细胞的血管生成。
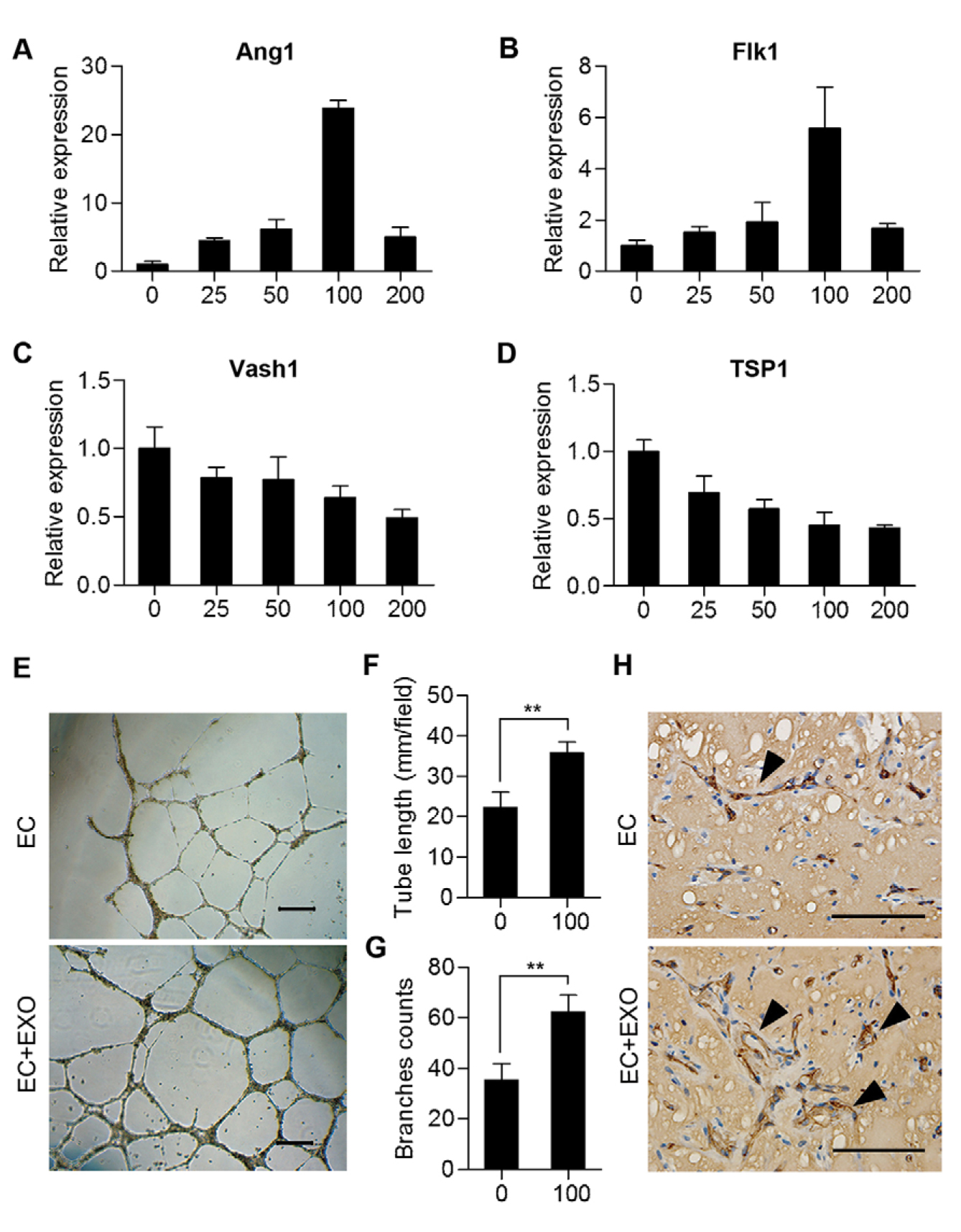
图2. adMSC-Exo在体外和体内促进内皮细胞血管生成。 (A-D)将HUVEC与不同浓度的adMSC-Exo(25μg/ ml,50μg/ ml,100μg/ ml和200μg/ ml)或载体对照(PBS)一起温育48h。 通过qRT-PCR评估Ang1,Flk1,Vash1和TSP1的mRNA水平(每组n = 3)。 (E)在用或不用adMSC-Exo(100μg/ ml)处理后筛选体外增强的HUVEC(EC)管形成。 比例尺:200微米。 (F,G)用adMSC-Exo处理HUVEC后的管长和分支数的定量评估; 在三个随机样本中计算管长度和分支数。 ** P <0.01(Student's t检验)。 (H)通过体内基质胶塞实验分析微血管结构。箭头表示微血管结构。比例尺:50um。
3、外泌体转移的miR-125a介导adMSC-Exo的促血管生成活性
研究已经证明MSC释放大量含有编码和非编码RNA的微泡,包括具有多种功能特性的miRNA。因此,假设adMSC-Exo可能通过转移特定的miRNA来增强HUVECs的血管生成。为此,研究进行了基于微阵列的miRNA表达谱分析(数据未显示)。根据这些数据,发现miR-125a在adMSC-Exo中富集,并且通过qRT-PCR验证了该结果(图3A)。为了研究miR-125a是否转移到HUVEC中,首先采用FAMmiR-125a转染adMSCs,然后用Dil标记含有FAMmiR-125a的分泌型外泌体,然后将其与HUVEC共培养,在荧光显微镜下,发现在HUVEC细胞质中检测外泌体红色信号(图3C)。此外,与未处理组相比,用外泌体处理的HUVEC中miR-125a水平显着增加(图3B)。为了进一步评估外泌体转移的miR-125a对血管生成的影响,使用miR-125a抑制剂(miR-125aI)在adMSCs中进行miR-125a敲低。数据显示,与用抑制剂对照(NCI-Exo)转染的细胞相比,转染了miR-125a抑制剂(125aI-Exo)的adMSCs分泌的外泌体中的miR-125a水平显着降低(图3D)。对于用125aIExo处理的HUVEC,qRT-PCR分析显示促血管生成基因(Ang1和Flk1)的表达水平显着下调,其伴随着抗血管生成基因(Vash1和TSP1)的上调(图3E,F )。管形成测定实验还显示125aI-Exo组中的血管长度和分支数量显着减少(图3G-I)。此外,为了加强MSC分泌的外泌体miR-125a对血管生成的作用,我们将HUVECs与转染了miR-125a或miR-125aI的MSC共培养并进行管形成测定。正如所料,当与用miR-125a转染的MSCs共培养时,HUVECs的管形成显着增强,但当与用miR-125aI转染的MSCs共培养时,HUVECs的管形成减少。因此,以上结果表明adMSC-Exo的促血管生成活性由miR-125a介导。
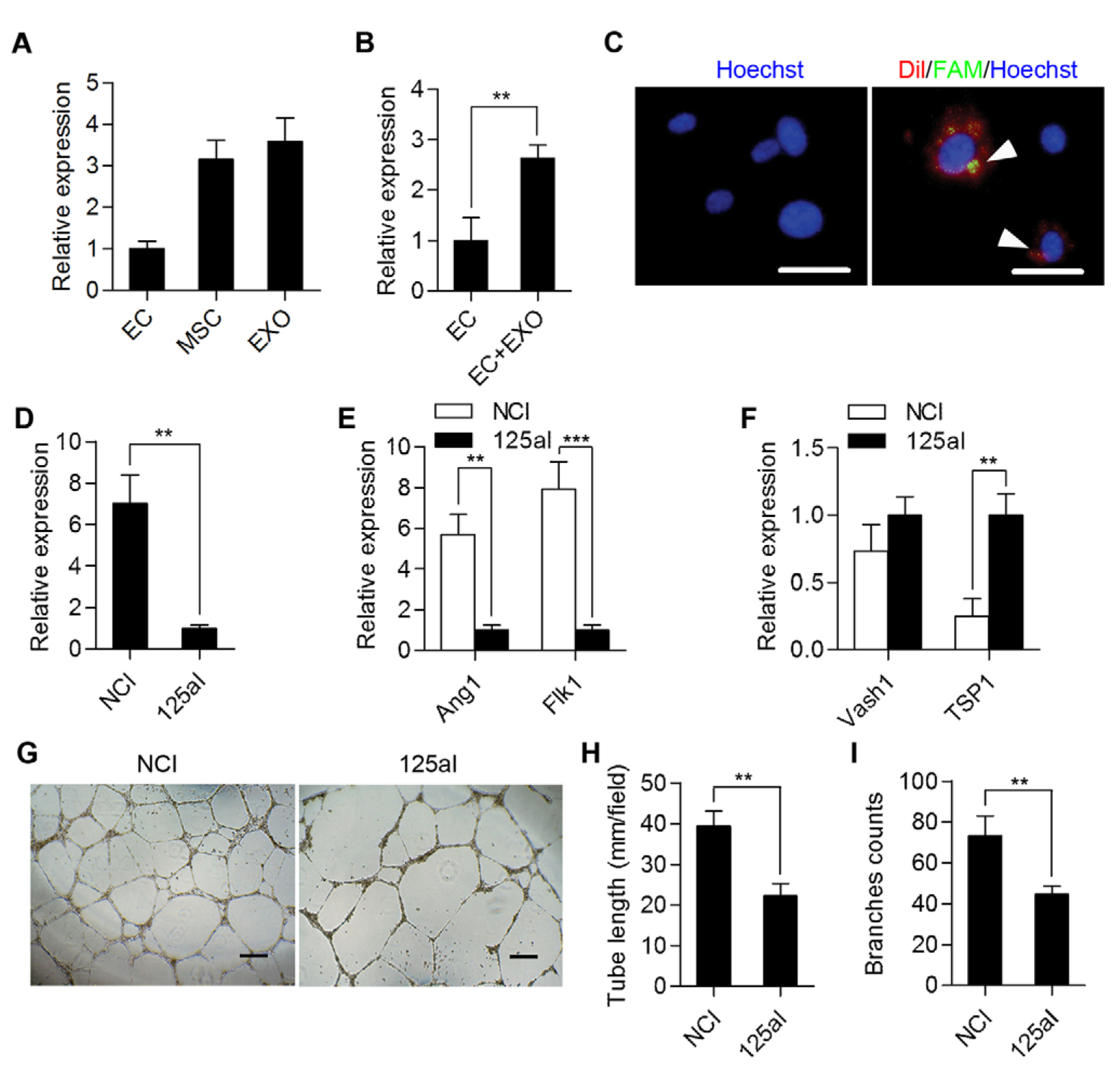
图3. 外泌体转移的miR-125a介导adMSC-Exo的促血管生成活性。 (A)通过qRT-PCR检测内皮细胞(EC),adMSC和adMSC-Exo(EXO)中miR-125a的mRNA水平。 (B)通过qRT-PCR检测adMSC-Exo处理后HUVEC中miR-125a的mRNA水平。 (C)将FAM-miR-125a转染到adMSCs,并收集其外泌体,并用Dil标记,然后将其加入到HUVEC中。 FAM-miR-125a信号是绿色而Dil是红色。细胞核用Hoechst 33342(蓝色)染色。箭头指示HUVECs细胞质中外泌体转移的miR-125a。比例尺:50um。 (D)通过qRT-PCR检测NCIExo和125aI-Exo中miR-125a的水平。 (E,F)将HUVEC与抑制剂对照NCI-Exo或125aI-Exo(100μg/ ml)温育。通过qRT-PCR检测Ang1,Flk1,Vash1和TSP1的mRNA水平。每组n = 3, ** P <0.01; *** P <0.001。 (G)评估用NCI-Exo或125aI-Exo(100μg/ ml)处理后体外的HUVEC管形成。比例尺:200um。 (H,I)用NCI-Exo或125I-Exo(100μg/ ml)处理后HUVEC的管长度和分支的定量评估,在3个随机样本中计算管长和分枝数。** P <0.01。
4、HUVECs中miR-125a的过表达增强体外血管生成
为了进一步研究miR-125a对血管生成的影响,将合成的miR-125a模拟物直接转染到培养的HUVEC中。 qRT-PCR检测显示在用miR-125a模拟物转染的HUVEC中促进血管生成基因(Ang1和Flk1)的表达水平上调,而抗血管生成基因(Vash1和TSP1)的下调(图4A,B)。 此外,管形成测定实验表明,用miR-125a模拟物转染的HUVEC中管长和分枝数显着增加(图4C-E)。 结合miR-125a抑制剂在adMSC-Exo中miR-125a敲低的结果,这些结果证实了外泌体中的miR-125a在内皮细胞血管发生中起关键作用。
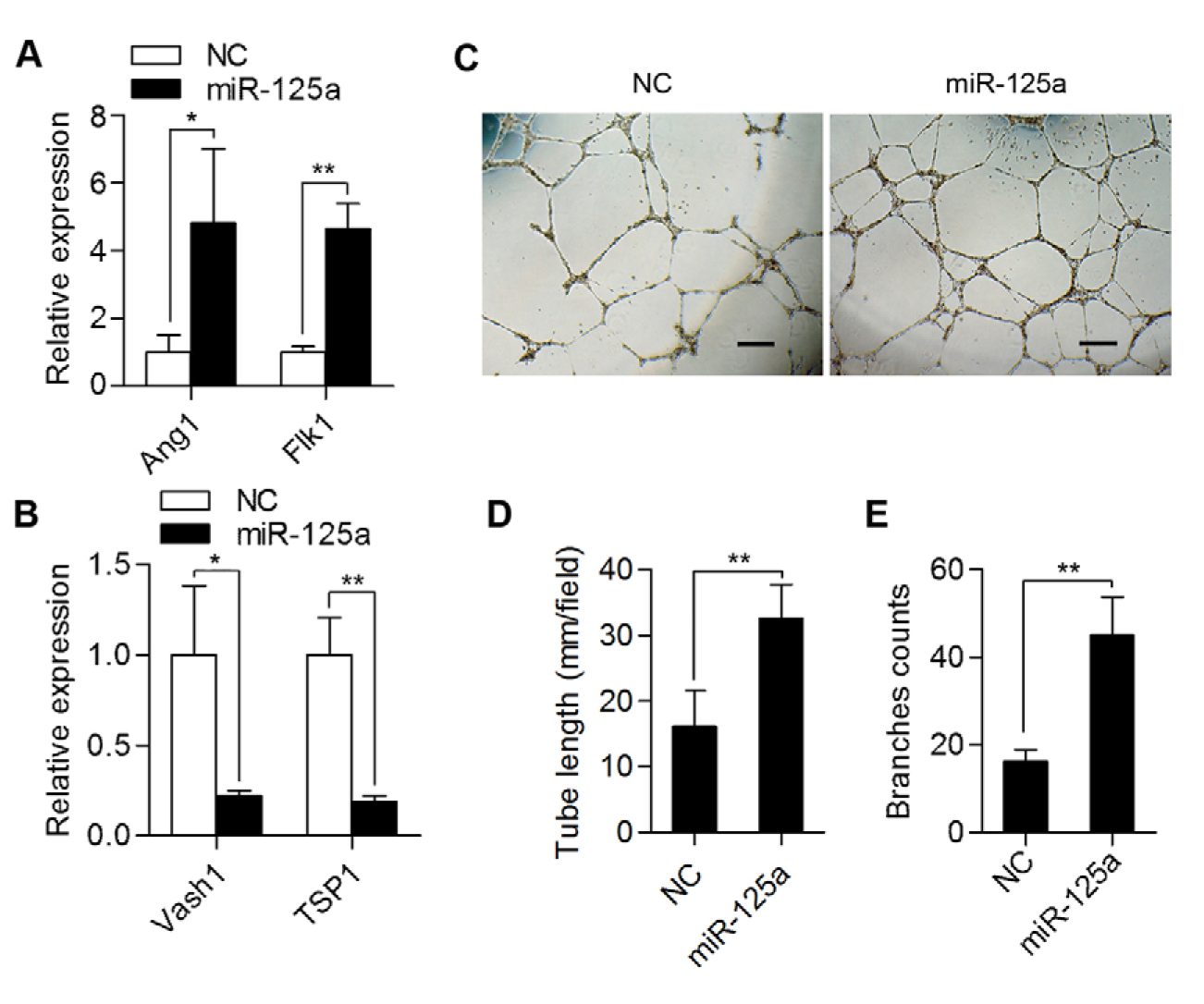
图4. HUVECs中miR-125a的过表达增强体外血管生成。 (A,B)用模拟对照(NC)或miR-125a模拟物转染HUVEC。 通过qRT-PCR检测Ang1,Flk1,Vash1和TSP1的mRNA水平。每组n = 3,* P <0.05; ** P <0.01。 (C)NC或miR-125a模拟物转染的HUVEC中的管形成实验。 比例尺:200um。 (D,E)NC或miR-125a模拟物转染HUVEC后管长度和分支数目的定量评估,在3个随机样本中计算管长度和分支数。** P <0.01。
5、DLL4是miR-125a的直接下游靶标
为了进一步揭示miR-125a促进血管生成活性的分子机制,通过TargetScan在线预测了miR-125a的潜在下游靶标。在预测的候选者中,关注Notch信号通路配体DLL4,它已被证实可以抑制血管生成。根据预测分析,DLL4的3'UTR中的miR-125a靶位点在脊椎动物中高度保守,并与miR-125a部分碱基互补(图5A)。为了验证miR-125a是否通过结合DLL4的3'UTR来抑制DLL4的表达,因此进行荧光素酶报告系统测定。将野生型(pRL-TK-DLL4-WT)或突变(pRL-TK-DLL4-MUT)DLL4的萤光素酶报告基因与miR-125a模拟物或模拟对照一起转染到293T细胞中。与模拟对照相比,miR-125a的过表达显着抑制了pRL-TK-DLL4-WT报告质粒(〜49.6%)但不并影响pRL-TK-DLL4-MUT报告质粒的荧光素酶活性(图5B)。因此,这些结果表明,DLL4是miR-125a的直接靶标。

图5. DLL4是miR-125a的直接下游靶标。(A)预测的DLL4-3'UTR与miR-125a的结合位点示意图。miR-125a的种子序列与DLL4的3'UTR区域(红色)匹配。 (B)在模拟对照(NC)或miR-125a转染的293T细胞中野生型(WT)或突变体DLL4 3'UTR的双荧光素酶测定,并且计算荧光素酶活性比。*** P <0.001。
6、外泌体转移的miR-125a通过DLL4调节内皮尖细胞的比例
先前研究已经表明,DLL4通过抑制内皮尖细胞形成来调节血管发生期间的内皮细胞发芽过程。 为了证实Exo和miR-125a通过DLL4调节血管生成,进一步检测了暴露于adMSC Exo或用miR-125a模拟物转染的HUVEC中DLL4蛋白表达水平以及内皮尖细胞形成。 Western印迹结果表明,与对照组相比,暴露于外泌体并用miR-125转染的HUVEC中的DLL4蛋白表达显着降低(图6C,D)。尖端细胞形成通过染色内皮尖细胞标志物CD34来评估。免疫染色实验表明,与对照组相比,用adMSCExo处理或用miR-125a模拟物转染的HUVEC中内皮尖细胞形成显著增加(图6E,G)。为了证实这一发现,采用流式细胞来量化CD34表达,结果显示,与未处理组和模拟对照组相比,外泌体和miR-125a处理组中CD34+内皮尖细胞的比例显着增加(每组n = 3)(图6F,H)。因此,得出结论:adMSC-Exo及其外体转移的miR-125a可以通过抑制DLL4表达促进内皮尖细胞形成比例来调节内皮细胞血管生成。
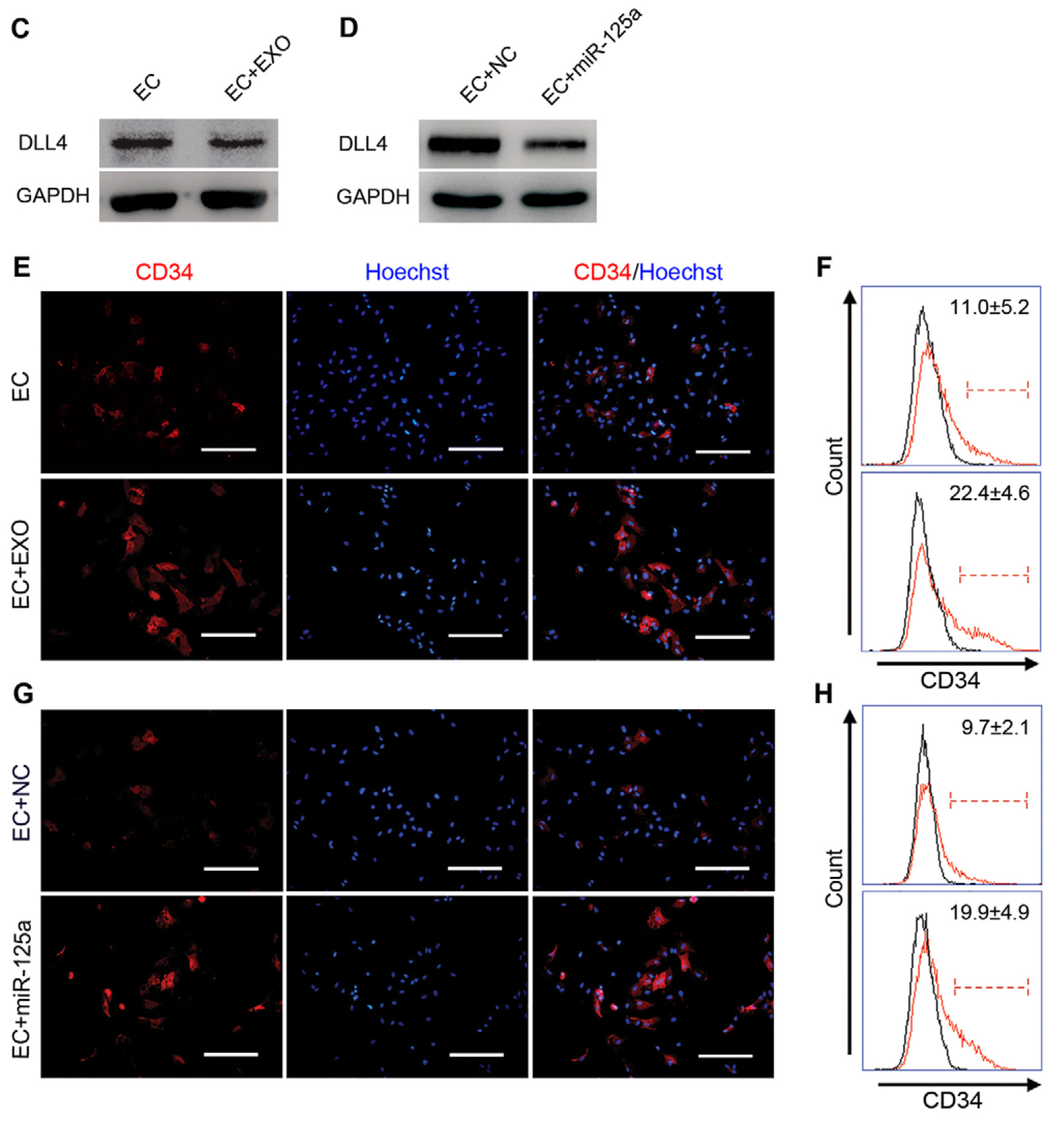
图6. 外泌体转移的miR-125a通过靶向DLL4调节内皮尖细胞比例。(C,D)用adMSC-Exo(100μg/ ml)处理或用miR-125a转染的HUVEC(EC)。通过WB检测DLL4的表达。 (E,G)用adMSC-Exo(100μg/ ml)处理HUVEC或用miR-125a转染HUVEC后,CD34 标记(红色)的内皮尖细胞的免疫荧光实验。细胞核用Hoechst 33342(蓝色)染色。比例尺:50um。 (F,H)HUVEC用adMSC-Exo(100μg/ ml)处理或用miR-125a转染后,通过流式细胞分离出CD34 +细胞群。来自三个独立的实验。
研究结论
adMSC-Exo及其外体转移的miR-125a可通过抑制DLL4表达促进内皮尖细胞的形成,从而调节内皮细胞血管生成。总之,本研究提供了内皮细胞和MSC之间的细胞间通讯的新思路,对外泌体转移miRNA的进一步研究可能为涉及血管生成的疾病与治疗提供机会。
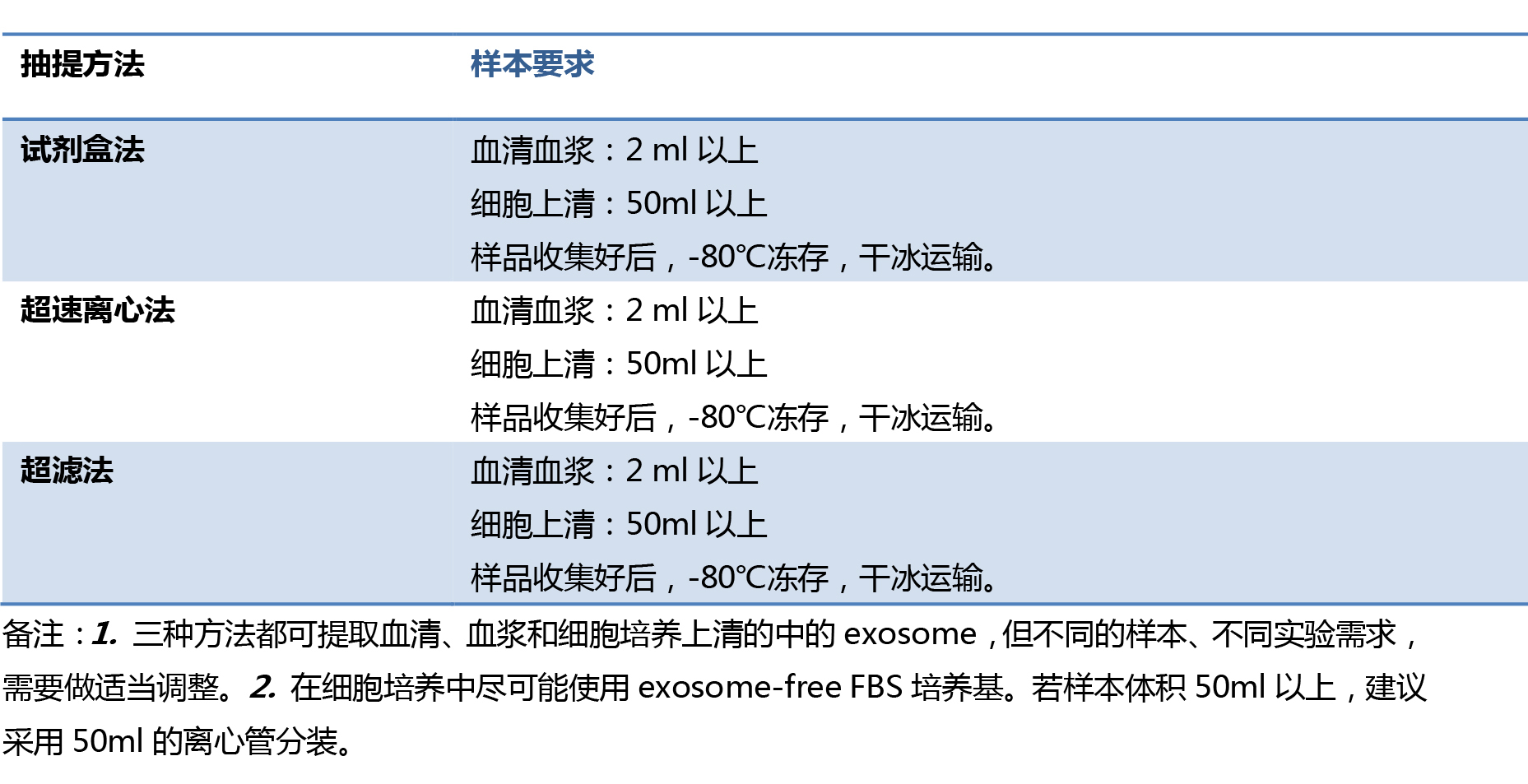
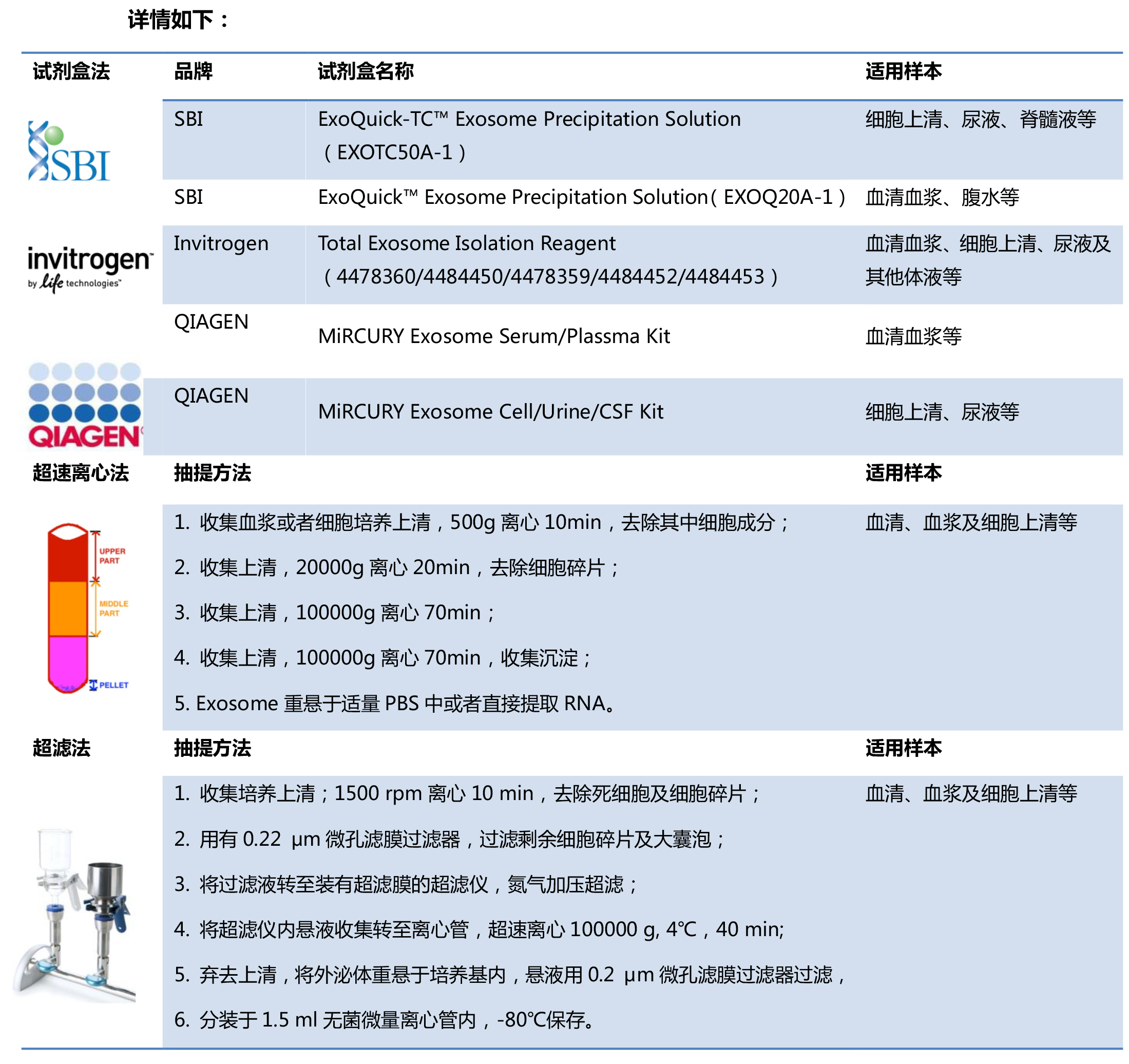
PS: 中康博可提供文中涉及的外泌体提取、电镜鉴定、miRNA芯片检测服务!(在外泌体提取及电镜鉴定这部分涉及的样本量、保存运输条件有进一步补充)

北京中康博生物科技有限公司(beijing Cnkingbio Biotechnology Co.LTD)是北方乃至全国最大的Affymetrix检测中心之一,公司以数据分析为特色,整合Affymetrix基因芯片、Illumina二代测序、个性化生物信息分析三项核心服务。立足生命科学,为临床与基础研究领域的科学工作者提供分子生物学高端技术服务。




